Résumé
En 2017, comme les années précédentes, peu de progrès cliniques sont recensés parmi les 92 nouveautés médicamenteuses analysées et publiées dans Prescrire. Des autorisations de mise sur le marché (AMM) de plus en plus précoces, une évaluation des médicaments a minima : les patients se trouvent exposés à des médicaments dont la balance bénéfices-risques est incertaine. Sans compter le prix exorbitant de certains médicaments et le gaspillage des ressources collectives.
Tous les mois, Prescrire publie une analyse indépendante et méthodique des nouveautés sur le marché des médicaments : nouvelles substances, nouvelles indications, nouvelles formes pharmaceutiques, etc. Sont suivis aussi de près : les effets indésirables des médicaments, les arrêts de commercialisation, les retraits du marché ou les ruptures de stocks, l'environnement autour du médicament, particulièrement au niveau de l'Union européenne, mais pas seulement. L'information ainsi apportée par Prescrire a pour objectif d'aider les abonnés à utiliser au mieux les médicaments et à repérer parmi les nouveautés celles qui apportent un réel progrès pour les soins.
Contrairement aux idées reçues, les firmes n'ont pas à apporter la preuve que leurs médicaments représentent une avancée : parmi les 92 nouveautés médicamenteuses, on retrouve toujours beaucoup d'absence de progrès (45 cotées "N'apporte rien de nouveau" dans le tableau ci-dessous). Et certains médicaments représentent même un recul dommageable, avec 15 nouveautés plus dangereuses qu'utiles (cotées "Pas d'accord").
Les progrès notables sont un peu plus nombreux que l'année précédente, au nombre de 10 (cotés "Intéressant" ou "Apporte quelque chose"), dont 3 médicaments en cancérologie et 3 en infectiologie (HIV et hépatite C). Et seulement deux médicaments utiles chez les enfants : des formes buvables de nitisinone (Orfadin°) et de raltégravir (Isentress°).
Le bilan de l'année 2017 ressemble à ceux des années précédentes, et nous pourrions reparler des dérives et dangers de la publicité pour les médicaments, de l'insuffisance d'information sur les effets indésirables, de la course aux nouvelles indications, des firmes en quête d'innovations faciles qui commercialisent des médicaments me-too (pour "moi aussi : je veux une part de marché") sans progrès pour les patients.
Voici plutôt quelques points cruciaux repérés en 2017.
Évaluation en vue de l'AMM : souvent bâclée
L'évaluation des médicaments en vue d'obtenir une autorisation de mise sur le marché (AMM) est trop souvent bâclée : au motif d'un accès plus rapide à l'"innovation thérapeutique", les autorités de santé acceptent l'octroi de ces AMM sur des données d'évaluation très insuffisantes, avec demandes aux firmes de poursuivre l'évaluation après l'AMM. Ainsi, l'évaluation se retrouve en partie financée par l'assureur maladie, la promotion du médicament se retrouve sans limite, et les patients sont exposés souvent sans le savoir à des médicaments dont on connaît peu ou pas l'efficacité clinique, et encore moins les effets indésirables. Et, souvent, on constate des années plus tard que les études menées post-AMM ont surtout servi à lancer des habitudes de prescription, et non pas à répondre aux questions en suspens (n° 405 p. 484 ; n° 407 p. 697 ; n° 409 p. 856).
Médicaments en cancérologie : illustration des dérives
28 nouveautés médicamenteuses sur 92 analysées en 2017 ont concerné des médicaments utilisés dans les cancers. Certaines de ces AMM ont été octroyées sans disposer d'essais comparatifs, par exemple pour : le daratumumab (Darzalex° - n° 405 p. 491-493) en monothérapie dans le myélome multiple après échec de plusieurs lignes de traitement ; le nivolumab (Opdivo° - n° 408 p. 730-733) dans la maladie de Hodgkin après échec d'une autogreffe de cellules souches hématopoïétiques et de la brentuximab védotine (Adcetris°) ; le crizotinib (Xalkori° - n° 404 p. 419) et l'osimertinib (Tagrisso° - n° 399 p. 11-13) dans certains cancers bronchiques.
Parmi ces 28 AMM de médicaments en cancérologie, 20 ont été accordées sur la base d'un seul essai clinique, souvent de qualité méthodologique médiocre car non comparatif ou avec des biais liés à son caractère non aveugle ; ou sur la base de critères biologiques ou radiologiques, pas forcément corrélés à un allongement de la durée de vie ou à une amélioration de la qualité de vie.
Certains progrès sont à noter, dont le pertuzumab (Perjeta° - n° 400 p. 94-95) dans des cancers du sein métastasés, le nivolumab (Opdivo° - n° 401 p. 170-171) dans des cancers du rein métastasés, et l'éribuline (Halaven° - n° 404 p. 416-417) dans des liposarcomes inopérables ou métastasés. La plupart des autres médicaments de cancérologie sont trop peu évalués, et plusieurs ont une balance bénéfices-risques défavorable, qui aurait dû empêcher de les autoriser.
En somme, dans le domaine de la cancérologie, on note beaucoup de commercialisations sur un marché rendu très attractif par sa facilité d'accès pour les firmes, à des prix exorbitants et déconnectés du progrès thérapeutique ou des coûts de recherche et développement (lire aussi "Nouveaux médicaments des cancers : mal évalués, peu efficaces et trop chers").
Marché des médicaments : retraits trop lents
Aux critères d'exigence très minces pour l'octroi d'AMM, s'ajoute un grand immobilisme des agences du médicament quand il s'agit de retirer ou suspendre l'AMM d'un médicament dont les effets indésirables sont disproportionnés par rapport aux bénéfices attendus.
Début 2017, en France, une solution buvable contenant de la vitamine D (Uvestérol° D - n° 400 p. 136 ; n° 401 p. 192) a été retirée du marché par l'Agence française du médicament (ANSM) après la mort d'un nourrisson, alors que pendant une vingtaine d'années les notifications d'accidents graves se sont accumulées. Et en juillet 2017, l'ANSM a retiré les AMM, datant des années 1970, des spécialités Proctolog° (trimébutine + ruscogénines) crème rectale et suppositoires en raison d'une balance bénéfices-risques jugée défavorable dans les affections hémorroïdaires et les fissures anales (n° 407 p. 664).
Mais de trop nombreux autres médicaments restent sur le marché, dont certains depuis plusieurs dizaines d'années, alors que leur balance bénéfices-risques est clairement défavorable (lire aussi "Pour mieux soigner, des médicaments à écarter : bilan 2018").
En somme
Pas assez de régulation de la part des autorités de santé, des AMM de plus en plus précoces, une évaluation des médicaments a minima : les soignants ont une place centrale pour choisir les médicaments qui ont un intérêt clinique démontré et pour limiter l'exposition des patients à des médicaments trop peu évalués, sans intérêt thérapeutique tangible ou plus dangereux qu'utiles.
Il s'agit de résister à la médicamentation massive de la société, aux conséquences majeures pour les victimes d'effets indésirables ou de dépendance aux médicaments. Médicamentation qui est aussi à l'origine d'un gaspillage de ressources collectives, amplifié par le coût exorbitant de certains médicaments (n° 406 - dossier "Médicamentation de la société").
Individuellement, on peut se sentir démuni face à un phénomène d'une telle ampleur et si complexe, surtout en l'absence de réponses collectives et concertées. Il existe pourtant des moyens importants pour résister et agir en conscience, en commençant par s'affranchir de l'influence d'intérêts qui ne sont pas ceux des patients, et aussi en partageant et argumentant avec les patients les limites des interventions médicamenteuses qui leur sont proposées, ou dont ils entendent parler.
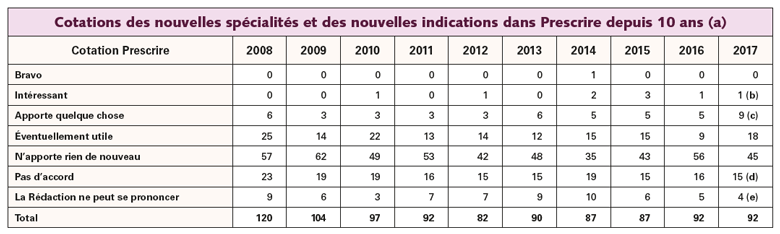
a- Ce tableau comprend les nouvelles spécialités (hormis les copies) et les nouvelles indications ainsi que les réanalyses "avec plus de recul". Les lecteurs intéressés par les résultats des années 1981 à 2007 peuvent les retrouver dans le n° 213 p. 59 et le n° 292 p. 136.
b- Il s'agit de l'asfotase alfa (Strensiq°) dans l'hypophosphatasie (n° 404 p. 406-407).
c- Il s'agit de :
– emtricitabine + ténofovir disoproxil (Truvada° ou autre) dans la prévention de la transmission du HIV (n° 407 p. 645-648) ;
– éribuline (Halaven°) dans les liposarcomes inopérables réfractaires ou en rechute (n° 404 p. 416-417) ;
– méthotrexate SC en stylos préremplis (Metoject°, Nordimet°) (n° 404 p. 405-406) ;
– méthotrexate injectable (Ledertrexate° ou autre) dans les grossesses extra-utérines (n° 409 p. 805-810) ;
– nitisinone buvable (Orfadin°) dans la tyrosinémie de type 1 (n° 410 p. 900) ;
– nivolumab (Opdivo°) dans les cancers du rein métastasés en 2e ligne après échec d'un inhibiteur de tyrosine kinases (n° 401 p. 170-171) ;
– pertuzumab (Perjeta°) dans les cancers du sein métastasés (n° 400 p. 94-95) ;
– raltégravir en granulés pour suspension buvable (Isentress°) chez les nourrissons infectés par le HIV (n° 402 p. 256) ;
– sofosbuvir + velpatasvir (Epclusa°) dans l'hépatite C (n° 410 p. 885-888).
d- Il s'agit de :
– adalimumab (Humira°) dans l'hidrosadénite suppurée chez les adolescents (n° 410 p. 902) ;
– ataluren (Translarna°) dans la myopathie de Duchenne (n° 408 p. 726-730) ;
– bévacizumab (Avastin°) en 1re ligne dans les cancers bronchiques (n° 402 p. 254) ;
– brentuximab védotine (Adcetris°) dans la maladie de Hodgkin (n° 408 p. 733-735) ;
– estrogènes équins + bazédoxifène (Duavive°) dans les symptômes liés à la ménopause (n° 401 p. 167-169) ;
– évérolimus (Afinitor°) dans les tumeurs neuroendocrines non fonctionnelles (n° 405 p. 493-495) ;
– fentanyl ionophorétique (Ionsys°) (non commercialisé en France au 9 janvier 2018) dans les douleurs (n° 409 p. 812-813) ;
– guanfacine (Intuniv°) (non commercialisé en France au 9 janvier 2018) dans le déficit de l'attention avec hyperactivité (n° 403 p. 329-332) ;
– nivolumab (Opdivo°) dans la maladie de Hodgkin après échec d'une autogreffe de cellules souches hématopoïétiques et de la brentuximab védotine (Adcetris°) (n° 408 p. 730-733) ;
– palbociclib (Ibrance°) dans les cancers du sein inopérables ou métastasés (n° 410 p. 901) ;
– pertuzumab (Perjeta°) avant la chirurgie d'un cancer du sein (n° 400 p. 92-94) ;
– reslizumab (Cinqaero°) dans l'asthme (n° 410 p. 893-895) ;
– sélexipag (Uptravi°) dans l'hypertension artérielle pulmonaire (n° 403 p. 337) ;
– tolvaptan (Jinarc°) dans la polykystose rénale autosomique dominante (n° 402 p. 253) ;
– vandétanib (Caprelsa°) dans le cancer médullaire de la thyroïde chez les enfants (n° 408 p. 737-738).
e- Il s'agit de :
– ivacaftor (Kalydeco°) dans la mucoviscidose (n° 406 p. 566-568) ;
– ivacaftor + lumacaftor (Orkambi°) (non commercialisé en France au 9 janvier 2018) dans la mucoviscidose (n° 406 p. 569-571) ;
– pembrolizumab (Keytruda°) en monothérapie dans les cancers bronchiques métastasés ou inopérables (n° 407 p. 656-658) ;
– téduglutide (Revestive°) dans le syndrome du grêle court chez les enfants (n° 404 p. 414-415).